在过去,复发/难治性(R/R)急性淋巴细胞白血病(ALL)成人患者的预后极差,约20%-40%的患者可获得缓解,总生存期(OS)仅为6个月。近年来,新型靶向治疗的出现改善了R/R B细胞ALL患者的预后。但针对R/R ALL有效治疗的需求尚未得到满足,特别是首次复发的患者。嵌合抗原受体(CAR)T细胞是一种基因工程T细胞,将来自抗体的细胞外抗原结合部分和来自T细胞信号蛋白的细胞内信号部分融合,具有1个或多个共刺激结构域。在临床试验中,不同CAR-T细胞构建体的CAR-T细胞的设计和制备过程差异很大,包括在靶向抗原、结合亲和力、共刺激分子、生产系统和转导技术等方面的差异。这些因素又影响存活T细胞的可用性、转导效率、制造时间以及T细胞扩增和持久性,从而影响杀伤白血病细胞的成功。近年来,CAR-T细胞在各种血液系统恶性肿瘤的治疗领域迅速发展。来自美国的研究者对CAR-T细胞治疗B细胞ALL的现状或进展进行了综述。
CAR-T细胞治疗B细胞ALL
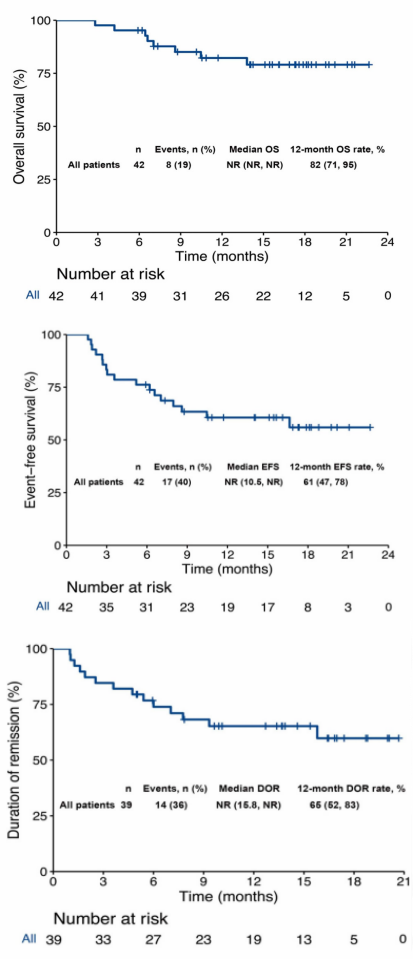
Tisagenlecleucel(tisa-cel)是美国食品药品监督管理局(FDA)批准的首个用于B-ALL的CAR-T细胞疗法。根据ELIANA试验,tisa-cel于2017年8月被批准用于≤25岁的难治性B-ALL患者或二次或以后复发的患者。表1总结了自体CD19 CAR-T细胞治疗B-ALL的部分主要试验。
表1
CRS和ICANS的管理
细胞因子释放综合征(CRS)和免疫效应细胞相关神经毒性综合征(ICANS)是与CAR-T细胞疗法相关的两种最突出的毒性,有可能造成危及生命的临床后遗症。虽然糖皮质激素可抑制与CRS相关的细胞因子风暴,但临床试验中的早期证据显示,使用类固醇后,CAR-T细胞功能和扩增可能受阻。因此,最初的建议和告诫CRS患者不要使用类固醇。然而,最近的研究数据表明,早期开始使用类固醇可能有助于预防严重的CRS/ICANS,并且可能不会对治疗效果产生有害影响。因此,临床医生应遵循已批准的CAR-T细胞产品的处方和各临床试验方案中列出的CRS和ICANS管理指南。
在CAR-T细胞时代,Allo-HSCT的角色不断演变
在一些关键试验中,CAR-T细胞疗法显示出显著的缓解率,并且在输注后1年,达到缓解患者中约有60%的患者无病生存。Allo-HSCT是CAR-T细胞疗法后进一步巩固缓解的方法之一,移植在当前治疗时代的作用是一个正在进行的研究和争论的主题。
在ELIANA试验中,少数患者(10例患者,即达到缓解患者的15%)后续接受了Allo-HSCT。移植时删失或未删失的无事件生存期(EFS)相似。相比之下,一项来自美国的儿童研究,患者接受带有CD28共刺激结构域的CAR-T细胞构建体治疗,75%的微小残留病(MRD)阴性CR患者(n=21)继续接受了Allo-HSCT,并且移植后5年EFS率为62%,中位OS为70.2个月。其余7例未接受后续Allo-HSCT的MRD阴性CR患者复发。一项回顾性分析纳入了52例儿童和年轻成人患者,这些患者接受CD19或CD22 CAR-T细胞治疗获得CR后,接受了降低强度预处理的Allo-HSCT,结果显示,1年OS率、EFS率和移植相关死亡率(TRM)分别为87.7%、73%和2.2%。
在成人和儿童患者中研究CAR-T细胞输注后的Allo-HSCT巩固治疗的不同作用时,应考虑到两个人群之间移植结局的差异。对CIBMTR数据集的分析显示,在首次CR期间接受移植的儿童和成人ALL患者的3年OS率分别为79%和64%。总体而言,接受Allo-HSCT的成人患者(尤其是合并症较多的老年患者)的非复发死亡率高于儿童患者。这些数据应谨慎解读,因为存在固有的偏差,选择接受Allo-HSCT的患者处于持续缓解期(或有再生障碍性骨髓),并且被认为足够适合接受移植。
目前CAR-T细胞治疗后的Allo-HSCT的作用尚不明确。MRD检测技术可能有助于确定CAR-T细胞治疗后的Allo-HSCT的获益患者。二代测序MRD是否可以识别CAR-T细胞治疗后有复发风险的患者,从而识别作为巩固治疗的Allo-HSCT的潜在候选患者仍有待确定。
CAR-T细胞治疗后的复发模式
患者接受自体抗CD19 CAR-T细胞治疗后会出现两种主要的复发模式。第一种为CD19阳性复发,与患者CAR-T细胞持久性差相关。第二种复发为CD19阴性,已被证明是通过多种机制发生,包括抗原逃逸、谱系转换和基因突变。对CAR-T细胞治疗后白血病进展机制的进一步了解推动了预防和治疗复发的相关研究。
CD19以外的靶点
尽管靶向CD19 CAR-T细胞疗法取得了令人鼓舞的结果,但仍有50%左右的患者会出现疾病复发。此外,一些患者在复发时出现CD19丢失,这引起了研究者对新抗原靶点的研究。
CD22
约90%的成人和儿童B-ALL患者都表达CD22。抗CD22 CAR-T细胞输注后,复发时原始细胞CD22表达降低,为了解决这一问题,研究者开发了一种具有抗CD22 low B-ALL强活性的全人源CD22 CAR-T细胞构建体。
联合靶点
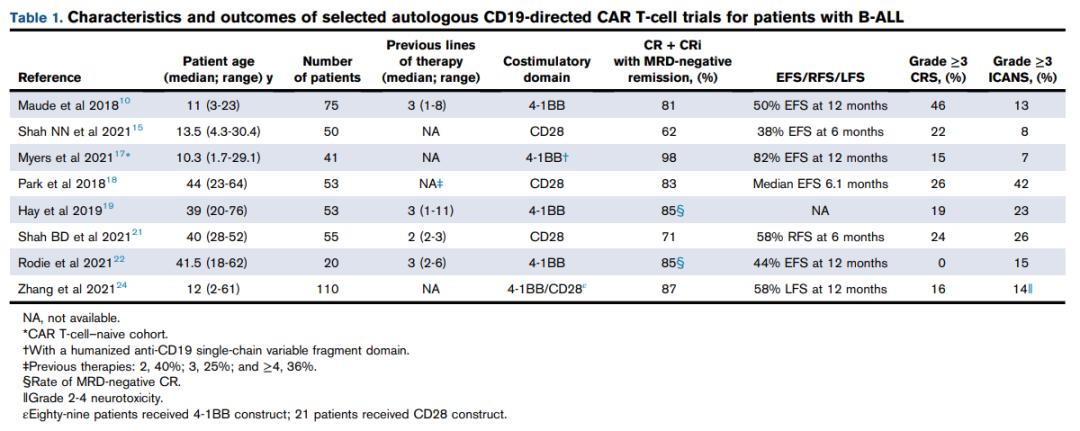
联合靶点治疗的发展是为了避免抗原逃逸复发。在B-ALL中探索最多的联合CAR-T细胞疗法为CD19和CD22。已使用不同策略生成双重抗CD19 /CD22 CAR细胞构建体(图1)。表2为双重靶向CD19和CD22治疗B-ALL患者的主要试验。针对3种抗原(CD19、CD20和CD22)的靶向治疗策略也已开发出来。由3个单独表达的CAR(TriCAR)或单个抗CD19 CAR和针对其他两种抗原的双特异性CAR(SideCAR)组成的Trivalent CAR-T细胞构建体已在体外显示出疗效。
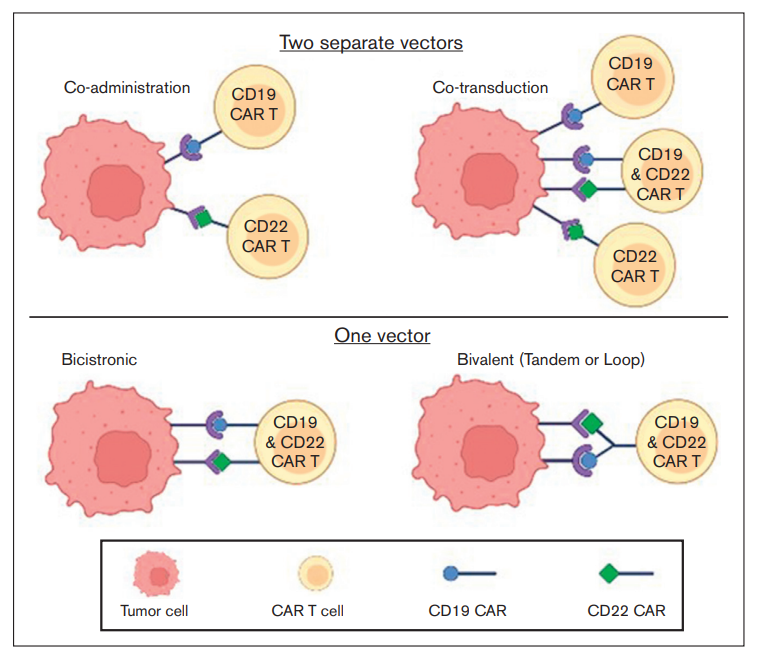
表2
已有研究报告了1例患者在双特异性CD19/CD22 CAR-T细胞疗法失败后接受抗CD38 CAR-T细胞治疗。虽然观察到抗CD38 CAR-T细胞具有一些抗肿瘤活性,但患者出现了主要毒性,这可能是由于靶向/脱靶肿瘤效应。临床前数据表明,CAR-T细胞治疗B-ALL的其他靶点可能发挥作用,如BAFF-R、CRLF2和CSPG4(用于MLL重排ALL)。
异基因CAR-T
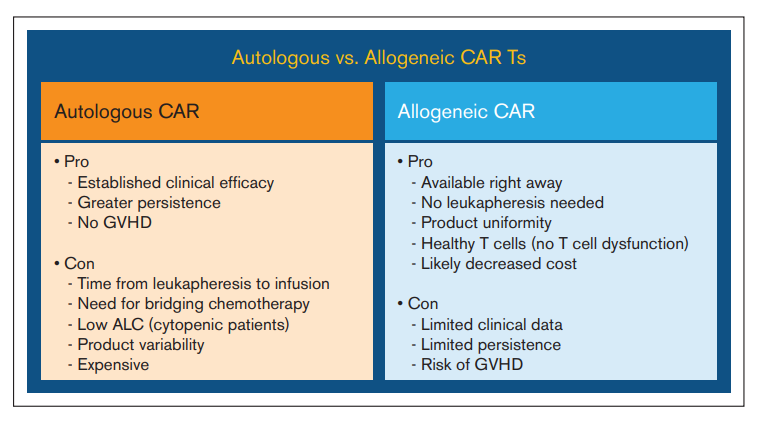
为了克服自体CAR-T细胞的一些缺点(如对个体化CAR的需求和耗时的制备过程),“现货”异基因CAR-T细胞是一种具有吸引力的选择。然而,异基因CAR-T细胞具有引发患者移植物抗宿主病(GVHD)的潜在风险。自体和异基因CAR-T细胞的优缺点见图2。
CAR-T细胞治疗成人B细胞ALL患者
研究者们已开始认识到CAR-T细胞疗法在B-ALL治疗中的作用。在CAR-T细胞获批之前,贝林妥欧单抗和奥加伊妥珠单抗分别以关键III期TOWER和INO-VATE试验获得FDA批准用于R/R疾病。在TOWER研究中,贝林妥欧单抗组约有3/4的患者处于挽救性1期(S1)或S2期,而INO-VATE试验仅在S1或S2期患者中评估了奥加伊妥珠单抗。对这两项试验的结果进行分析,这些药物作为早期挽救治疗时,EFS有所改善。相比之下,在ZUMA-3试验中,患者既往接受过中位数为2的多线治疗,并且近一半的患者既往接受过至少3线治疗。虽然进行交叉试验比较困难,但可以了解到CAR-T细胞疗法在诱导晚期患者缓解方面的作用,因此,明智的做法是将CAR-T细胞疗法推广至B-ALL的早期治疗线。自体CAR-T细胞主要用于既往接受过多线治疗的患者(表1)。在儿童和成人患者中,较少的治疗线数与较高的缓解率相关。
新的研究数据表明,CAR-T细胞疗法在低肿瘤负荷的情况下(如在MRD阳性患者中)更有效。CAR-T细胞作为诱导治疗后的巩固治疗可进一步改善CAR-T细胞在B-ALL中的应用。一种未来治疗方案似乎是合理的,该方案包括第一阶段化疗,以实现肿瘤减积,然后继续进行CAR-T细胞输注作为巩固。
对CAR-T细胞疗法后的Allo-HSCT作用仍在继续探索。对于CAR-T细胞输注前未接受过Allo-HSCT的成人患者,可以考虑在缓解期接受CAR-T细胞治疗后接受Allo-HSCT,但需要注意的是这方面的数据仍存在争议。对于CAR-T细胞输注前已接受过Allo-HSCT的患者,是否接受第二次Allo-HSCT将取决于第一次移植后的缓解持续时间、移植后并发症和供者特征。
总结
CD19 CAR-T细胞疗法的引入彻底改变了B细胞ALL和其他CD19+ B细胞恶性肿瘤的治疗。随着目前这一代CAR产品的获批,可以看到它们在R/R B细胞ALL方面令人鼓舞的临床活性。CAR-T细胞相关的毒性是可控的,大多数研究机构已经开发了临床实践流程来管理相关毒性。对CAR-T细胞疗法仍在不断探索,临床开发中出现了一些新型结构、新型靶点和联合靶点,包括异基因CAR。在未来几年内,期待看到将CAR-T细胞纳入早期治疗试验中,让更多B细胞ALL患者得到长期的疾病控制。