在过去50年中,蒽环类药物和阿糖胞苷联合治疗方案(“3+7”)仍然是适合接受强化诱导治疗的新诊断(ND)急性髓系白血病(AML)患者的标准治疗。65%-75%的年轻患者(≤60岁)和40%-60%的老年患者(>60岁)可达到完全缓解(CR)。然而,接受强化化疗(IC)的不良风险患者的CR率显著较低,根据2017年修订版欧洲白血病网(ELN)遗传风险分层,不良风险患者接受IC的预后比良好和中等风险的患者差。>60岁的不良风险患者的CR率仅为43%-45%。维奈克拉(VEN)联合小剂量阿糖胞苷或去甲基化药物在不适合接受IC治疗的老年ND AML患者中显示出了良好的安全性和疗效。
VIALE-A试验表明,在所有基因组风险人群中,VEN和阿扎胞苷的联合治疗均显著改善了老年和unfit患者的复合完全缓解(CRc)率和总生存期(OS),即使在伴不良细胞遗传学风险和高危分子学突变患者中。因此,亟需开展一项以VEN为基础的方案在ND不良风险的年轻成人AML患者中的研究。苏州大学附属第一医院吴德沛、陈苏宁教授及其团队开展了一项多中心、单臂的II期研究,该研究旨在评估ND伴有不良风险(ELN 2017)的年轻成人AML患者接受VEN联合地西他滨(DEC)诱导治疗的疗效和安全性。
研究方法
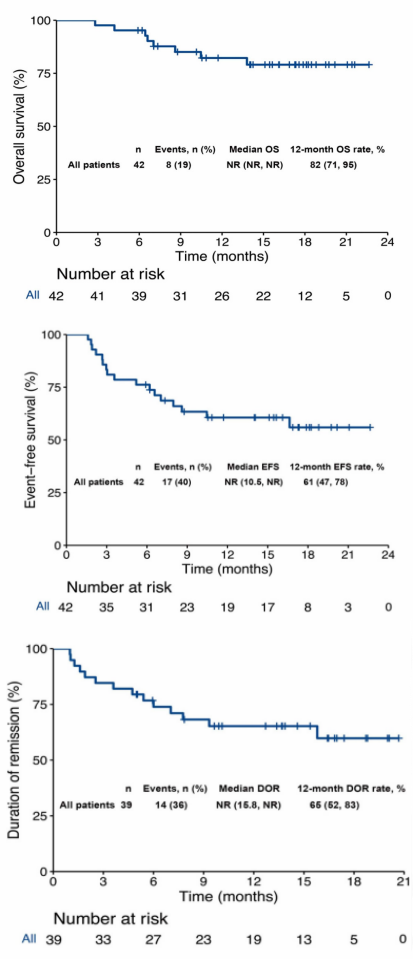
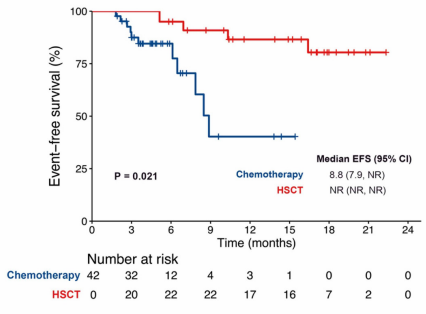
2021年2月至2022年7月,该研究在中国的两个临床中心(苏州大学附属第一医院和苏州弘慈血液病医院)招募患者。第1个周期:第1-5天,DEC 20 mg/m2,静脉注射;第1天,VEN 100 mg,第2天200 mg,第3-28天400 mg。对于FLT3-ITD等位基因比率(AR)较高的患者,可选择第3-28天口服索拉非尼 400 mg,每天2次。未达到缓解或获得部分缓解的患者接受1个周期的VEN (400 mg,第1-28天)和DEC(20 mg/m2,第1-5天)治疗。采用大剂量阿糖胞苷(2 g/m2,每12 h 1次)巩固治疗1-2个周期后,在第1-3天接受异基因造血干细胞移植(allo-HSCT)。主要终点为CRc(定义为CR+CR伴血液学不完全恢复[CRi]和形态学无白血病状态[MLFS])。次要终点为总生存(OS)、无事件生存期(EFS)、缓解持续时间(DOR)和安全性。
研究结果
该研究共纳入42例患者,其中男性26例,女性16例,中位年龄为39岁(范围:19-58岁),预估患者缓解的情况如图1。93%(39/42)的患者在2个疗程后达到CRc,79%(33/42)的患者在第2个疗程开始前达到CRc(表1)。7%(3/42)的患者在2个疗程诱导治疗后未达到CRc。
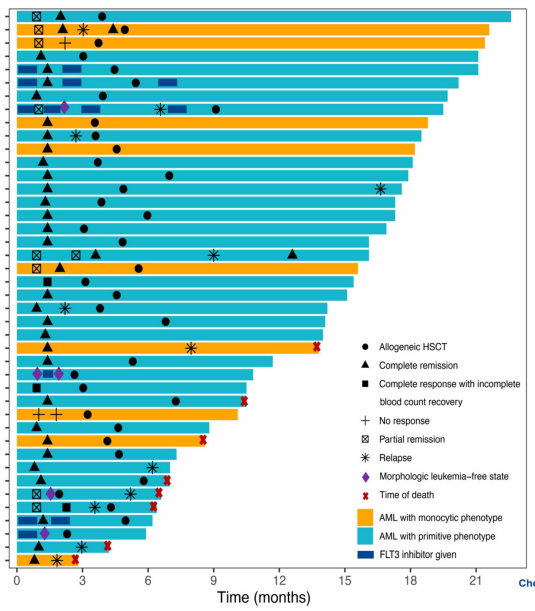
表1

全部患者(42例)接受安全性分析。在开始治疗前进行降细胞治疗,将WBC计数降低至25×109/L以下,未观察到肿瘤溶解综合征。最常见的≥3级的血液学不良事件(AE)为的血小板减少症(30例患者[91%])、中性粒细胞减少症(29例患者[100%])和贫血(29例患者[91%])。值得注意的严重AE包括肺炎、发热性中性粒细胞减少症和脓毒症,发生率为别为14%、26%和2%。
研究结论
作为首项VEN联合DEC治疗伴有不良风险(ELN 2017)的ND AML年轻成人患者的研究,该方案有效且耐受性良好。FLT3-ITD AR≥0.5患者的CRc和预后改善突出了FLT3抑制剂与基于VEN的方案联合使用的潜在益处,需要进一步验证。特别是在ELN 2022中,仅有FLT3突变不再定义为不良风险。一项III期随机研究即将在不良风险ND AML患者中进行,以比较该方案与IC方案的疗效。
