尽管可以接受强化化疗和新疗法治疗,复发/难治性(R/R)急性淋巴细胞白血病(ALL)和淋巴母细胞淋巴瘤(LL)的患者预后仍较差,显然需要新的治疗方法。BCL-2和BCL-XL抑制剂在ALL临床前模型中具有协同抗白血病作用。将高度选择性BCL-2抑制剂Venetoclax(Ven)添加到低剂量的BCL-2/BCL-XL/BCL-W抑制剂Navitoclax(Nav)中,可能会减轻标准剂量Nav(J Clin Oncol.2012;30:488)引起的Nav相关的剂量限制性毒性(DLTs),同时还可以保持疗效。在之前的一份报告(Lacayo ASH 2019;285)中,使用Ven+Nav耐受性良好,无意外毒性,初步疗效良好。本文,我们报告接受Ven+Nav和化疗治疗的R/R ALL或LL的患者的生存率、亚组和生物标记物更新数据。
研究目的
研究Ven+Nav联合化疗治疗R/R ALL和LL的儿童及成人患者的安全性和有效性。
研究方法
这是一项多中心、开放标签、剂量递增的Ⅰ期研究(NCT03181126),纳入≥4岁的R/R ALL和LL患者,每天接受400 mg Ven(重量调整当量)治疗。对于体重≥45kg的患者,口服3种剂量水平的Nav(每日25、50、100mg),对于体重<45kg的患者,口服2种剂量水平的Nav(每日25、50mg)。研究者决定患者是否接受化疗,化疗药物包括peg-天冬酰胺酶(peg-asparaginase)、长春新碱和地塞米松。第8天和第36天进行疾病评估和微小残留病(MRD)评估。
研究结果
截至2019年11月8日,47名患者已进入剂量递增阶段;46名患者(25名B细胞急性淋巴细胞白血病[B-ALL]、18名T细胞急性淋巴细胞白血病[T-ALL]和3名LL)有可用的临床数据。在研究入组时,46名中的5名患者有形态学完全缓解(CR)(原始细胞<5%)。中位年龄为29岁(范围:6-72);既往治疗的中位数为4(范围:1-10)。
研究中位时间为9.2个月(范围:6.1-12.9)。在7名患者中观察到DLTs:中性粒细胞减少(剂量水平1);中性粒细胞减少和药物性肝损伤(剂量水平2);缺血性肠病、高胆红素血症、全血细胞减少和延迟计数恢复(剂量水平3)。
基于贝叶斯最优区间(BOIN)设计制定剂量递增。随着DLTs的增加,没有证据表明在剂量水平3疗效增加,对于体重≥45kg的患者,Nav(联合400mg Ven)的2期研究推荐剂量(RP2D)为50mg,对于体重<45kg的患者,RP2D为25mg。
最常见的3/4级不良事件(AEs)为发热性中性粒细胞减少(39%)、中性粒细胞减少(26%)和低钾血症(24%)。治疗中出现的与Ven或Nav相关的非血液学3/4级AEs包括呕吐(n=3)、ALT升高(n=2)和败血症(n=2)。一个致命的肠缺血事件与研究药物组合有关。
25例(54%)患者的最佳缓解达到CR(CR/CRi/CRp),其中15例(33%)实现MRD阴性(uMRD)。B-ALL患者中位总生存期(OS)为9.7个月,T-ALL患者中位OS为6.6个月。11例(24%)患者进行干细胞移植或嵌合抗原受体T细胞(CAR-T)治疗。
在儿童患者中也观察到类似的疗效,CR/CRi/CRp率为58%,uMRD为50%,中位OS为9.7个月。在其他亚组中观察到相似的CR率(如图)。
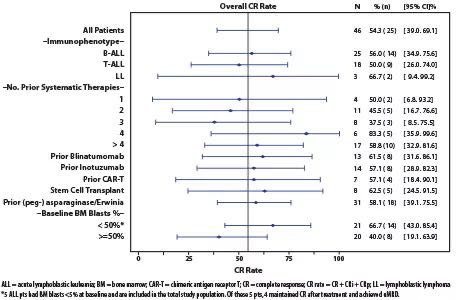
初步的BH3图谱分析显示,基线时T-ALL细胞中存在BCL-2依赖,而B-ALL细胞中存在BCL-2和BCL-XL依赖,进一步支持了Ven+Nav的联合应用。
结论
Ven+Nav联合化疗的耐受性良好,对经大量预处理的患者(包括既往blinatumomab、inotuzumab或CAR-T治疗)有较好的疗效,CR/CRi/CRp率高。正在进行临床随访、相关生物标记物分析和扩大队列登记,以评估间断给药的效果。